老年痴呆不能小看,现实情况比想象中更加严峻!
由《健康中国行动(2019-2030)》国家卫健委举行新闻发布会指出,我国老年人口数以及痴呆症患病率是5.56%,按照这个计算,目前我国的老年痴呆症的患者估计达到900多万,预计到2050年将会超过4000万!
老年痴呆症也叫“阿尔茨海默病”(英文缩写:“ AD”),是一类主要发生于老年人,且以进行性认知功能障碍和行为损害为特征的中枢神经系统退行性病变。神经系统退行性病变的特点就是减少大脑和脊髓中的细胞数量,这些细胞通常不可再生。
近年来,科学家开展了大量关于阿兹海默症的研究,使用氢氧吸入法对抗神经退行性疾病也成为研究热点之一。
01
科学家为何将氢气用于疾病研究?
众所周知,氢分子是最小的分子,由两个质子和电子组成,它能够轻而易举地穿透生物膜如血脑屏障、胎盘等等,达到靶器官(脑)和细胞器(线粒体、细胞核)。
过去,氢气被认为在哺乳动物细胞中具有生理惰性。直到1975年,科学家首次发现氢分子在皮肤鳞癌小鼠模型中表现出积极效果,科学家这才开始加强对氢分子医学的研究。【1】
后来,科学家发现,氢分子具有抗炎症、抗氧化应激、抗细胞凋亡、提升线粒体效率、提升免疫力等机制,吸入氢气也被应用到呼吸系统疾病【2】、睡眠障碍【3】、肿瘤疾病【4】等多种疾病模型中去。
基于上述“特点”,有科学家开始研究:“如何应用氢分子对抗阿兹海默症?”
02
阿兹海默症的发病机制
阿兹海默症(缩写为:AD)是最常见的导致痴呆的神经退行性疾病。阿兹海默症患者通常表现为学习和记忆能力下降、认知功能受损、正常的社会和情绪障碍。
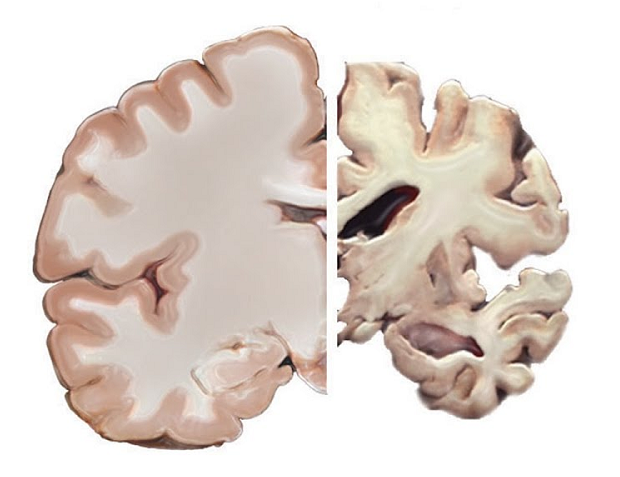
健康大脑(左)和阿兹海默症患者大脑对比
病理学上,氧化应激和炎症是促成阿兹海默症的主要机制。
科学家发现,人体的血液循环中含有一种被命名为:“Aβ”(β-淀粉样蛋白)的物质。当阿兹海默症患者产生Aβ(β-淀粉样蛋白)积聚沉积后,会产生过度磷酸化的tau蛋白,tau蛋白会引起线粒体损伤,导致能量功能障碍、ROS产生,并最终伤害突触特性。
同时,Aβ过度产生会导致线粒体功能障碍,会产生过度的ROS,引起神经炎症、氧化应激反应等。同时,也会导致三磷酸腺苷(ATP)的消耗!
ATP对轴突运输的神经传递很重要,有助于维持细胞内部和外部的离子通道功能和离子平衡。
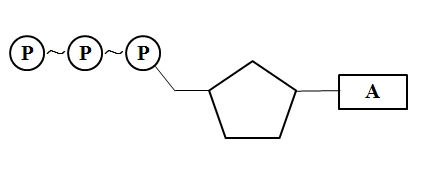
ATP分子简式A-P~P~P,式中的A表示腺苷,T表示三个(英文的triple的开头字母T),P代表磷酸基团,“-”表示普通的磷酸键,“~”代表一种特殊的化学键,称为“高能磷酸键”
在ATP消耗的同时,增加的ROS会导致线粒体孔的两极发生变化,导致钙离子流入线粒体,从而加重线粒体损伤。此外,ROS还会影响膜功能,导致脂质过氧化、促进细胞凋亡、并减少神经元数量,这些导致了阿兹海默症的发生。
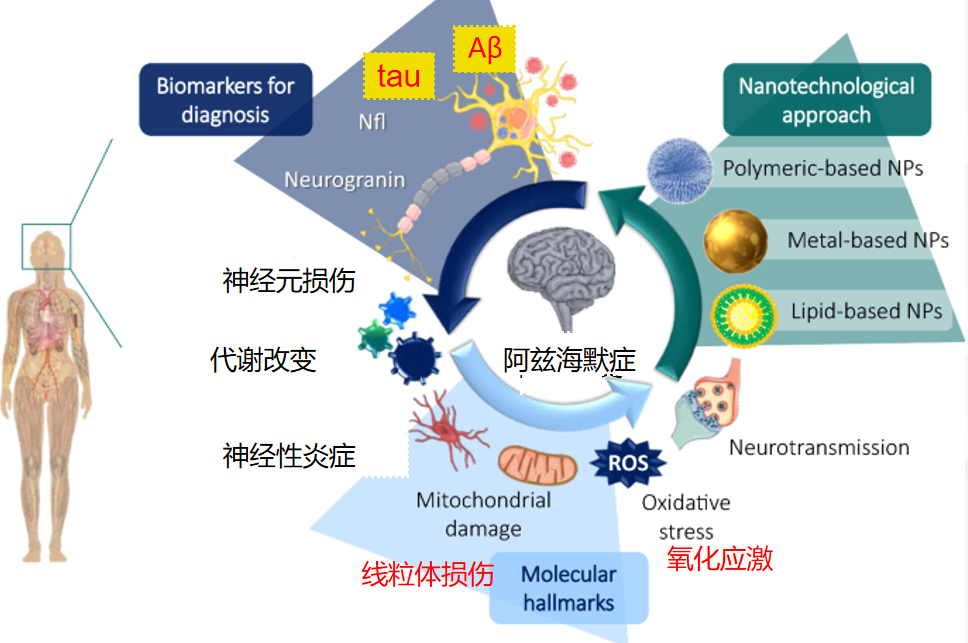
阿兹海默症发病机制
上图基本阐述了阿兹海默症的发病机制。研究发现,氢气在抗炎症、抗氧化、保护线粒体、提升免疫力等方面具有功效,生物还原氢能够通过消除氧化应激和激活抗氧化途径,恢复线粒体功能障碍,抑制 Aβ 生成和聚集,阻断突触和神经元凋亡,促进神经元能量代谢,从而改善阿兹海默症认知障碍。【6】
氢气作用于阿兹海默症
03
氢分子抗炎症
在对抗阿兹海默症的研究中,氢分子被证明具有抗炎症的作用【8】。
在许多疾病模型中,吸入氢气之后,大部分促炎细胞分子都出现下降趋势:如核因子-κB、46白细胞介素-1β、白细胞介素-6、白细胞介素-10、肿瘤坏死因子-α(TNF-α)、趋化因子(C-C基序)配体2、干扰素-γ和细胞间粘附分子-1等【9】。
这种抗炎症的作用也存在于阿兹海默症模型之中。
发表在《Mol Neurobiol.》上的一篇文章【10】表示,在阿兹海默症转基因小鼠模型中,发炎小体3(NLRP3 inflammasome)的下降,被证明能抑制记忆损伤和Aβ沉积。
一项研究报告显示,氢分子可以抑制阿兹海默症大脑中炎症小体3的激活。【11】因此,氢气可以对Aβ沉积产生影响,改善ROS增加的情况,保护线粒体。
04
氢氧混合吸入保护线粒体
对抗阿兹海默症,关键就在于清除恶性自由基的氧化损伤,保护线粒体合成ATP。
大量研究表明,氢分子本身具有抗氧化损伤的作用,氢气可以和恶性自由基中和,从而清除恶性自由基,以此保护线粒体的健康。
氢分子结构图
与此同时,氧气则是线粒体进行正常的有氧呼吸、产生ATP的原材料之一。
因此,科学家得出结论:吸入氢氧混合气体,有利于保护线粒体,并产生ATP。Ostojic SM等人的实验证明了这一点。这在对抗阿兹海默症方面具有积极意义。【12】
05
氢气与Sirt1-FoxO3a轴
近年的实验研究还发现,氢气还通过sirtuin 1(Sirt1:细胞衰老中细胞核自噬底物新成员)依赖途径刺激AMP活化蛋白激酶(AMPK),该途径上调叉头盒蛋白O3a(FoxO3a)下游抗氧化反应,并减少Aβ诱导的线粒体电位丢失和凋亡。
FoxOs可调节与细胞存活、衰老和氧化还原平衡有关的多个基因的表达。
FoxO3a被认为是sirtuin 1(Sirt1)必不可少的底物,可以形成复合物,诱导活性氧解毒机制,如超氧化物歧化酶(SOD)和过氧化氢酶对氧化应激的反应【13】。
Sirt1-FoxO3a轴
Sirt1-FoxO3a轴是一条进化上非常保守的途径,有利于细胞在氧化应激下存活。在多细胞生物中,已知FoxO3a蛋白调节氧化应激反应、应激耐受性和寿命,这表明Sirt1-FoxO3A轴可能是对抗老年相关疾病(如阿兹海默症)的有益途径。
持续暴露于高水平的ROS会导致FoxO3a降解,从而激活线粒体凋亡信号。因此,FoxO3a作为一个主开关,可能在神经元存活和凋亡的分支点调节ROS信号。
因此,氢气通过这条途径,帮助神经元细胞抗氧化、抗凋亡,在对抗阿兹海默症的过程中,起到意想不到的效果。
06
氢气与脑肠轴
2021年的一篇关于氢气改善肠道菌群的研究中,肠道菌群在氢分子的环境中得到改善【14】,情况如下:
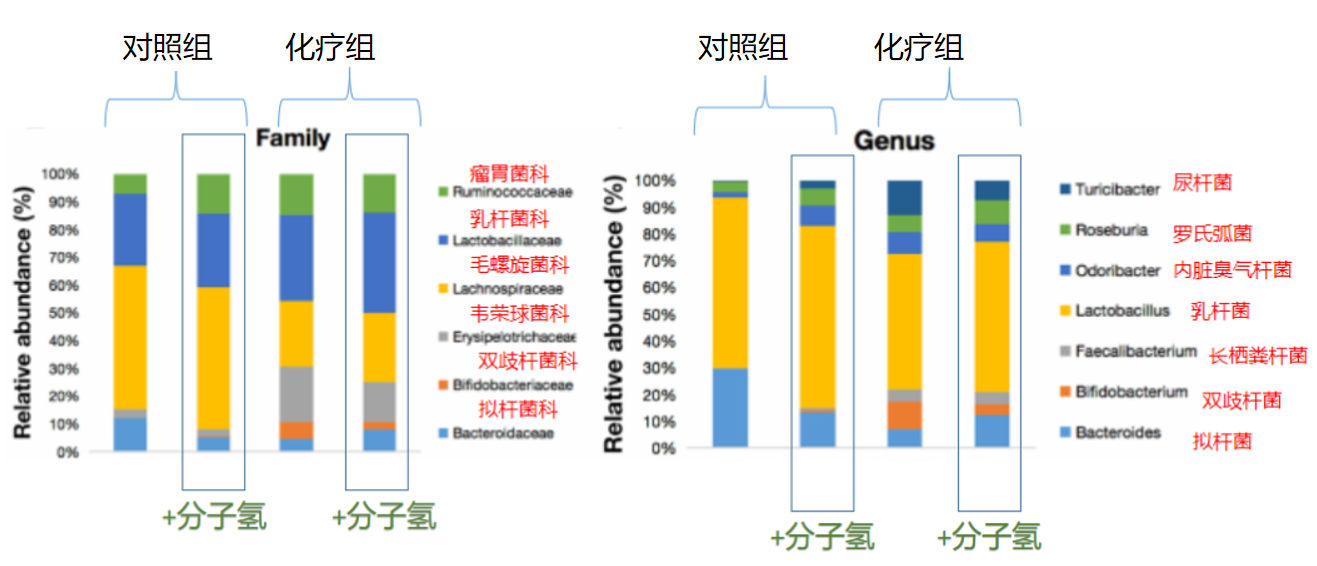
可以看到,在氢气的环境下,肠道菌群的组成得到调整。
肠道菌群环境会影响人体免疫能力。如下图:
良好的肠道环境影响免疫系统
肠道菌群也会通过肠-脑轴影响大脑状态,如下图:
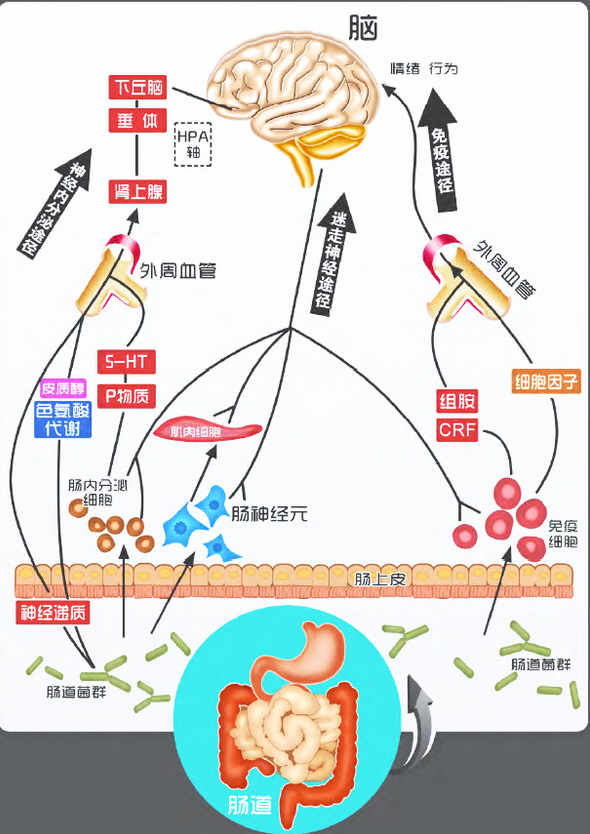
“肠-脑轴”系统:肠道菌群间接影响大脑
2018年的Nature的一篇研究证明,肠道菌群参与调控脑发育、应激反应、焦虑、抑郁、认知功能等中枢神经系统活动。肠道菌群、肠道和脑这3者间进行着密切的信息交流,使得我们对行为和情绪的调控方式有了全新和更全面的认识。【15】
肠道菌群是机体的重要组成部分,肠道菌群的作用不仅局限于胃肠道,而且可以通过肠-脑轴的3条途径(免疫、神经内分泌和迷走神经途径)形成肠道菌群-肠-脑轴,能够对脑功能和行为产生重大的影响。通过氢气改善肠道菌群环境,间接作用于神经系统,甚至改善相应疾病。
同时,发表在国际学术杂志上的一个实验表明,在痴呆小鼠模型中,摄入氢气可以防止认知能力下降,维持神经祖细胞的增殖,并抑制慢性束缚应激后的氧化应激。他们观察到丙二醛和4-羟基-2-壬醛的升高,这些被认为是慢性束缚应激增强的氧化应激标记物,被氢气抑制。【16】
2010年,科学家发现,氢气可以减少Aβ诱导的大鼠学习记忆障碍和神经炎症。他们观察到,氢气极大地改善了学习记忆和长时程增强作用(LTP,这是一种与学习记忆密切相关的突触可塑性形式)。【17】
在天津医科大学总医院做的一个国家自然科学基金研究项目中,科学家发现:类似的情景也在老人髋部骨折术后谵妄中出现。在对80位老年人的临床研究中,通过氢氧混合吸入(氢气66.6%+氧气33.3%)可以降低老年患者骨折POD的发生率,其机制也与调控炎症反应、氧化应激有关。【18】
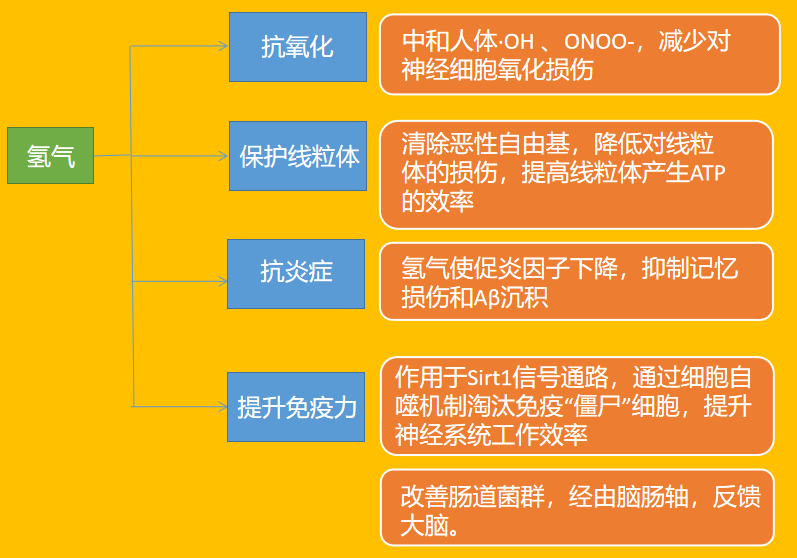
综上所述,我们目前发现:在阿兹海默症的发病机制中,①氢气可以直接或间接抑制Aβ 生成和聚集,②抗氧化(氢气中和ROS),③抗炎症(炎症小体减少),④恢复线粒体功能,⑤提升免疫能力,从而对阿兹海默症产生积极的影响。
除这些以外,目前许多与氢分子对抗“老年痴呆”的研究仍在大力推进中,相关临床实验的计划也在逐步酝酿!
注意:以上实验尚处于动物实验阶段,不可替代药物,不具备临床指导意义。