高评分眼科研究发布
2021年11月7日,国际分子科学杂志(IJMS)发布了一篇评分达到6.1分的氢氧医学研究论文。该论文研究了高浓度氢氧混合气体(66.6%氢气+33.3%氧气)吸入对老年性黄斑变性(简称:AMD,老年人致盲的主要原因)的积极作用,这篇高分值文章的发表为氢氧医学在眼科领域的研究奠定坚实基础。
老年性黄斑变性(Age-related macular degeneration,缩写:AMD),是一种与年龄密切相关的疾病,年龄越高发病率越高,现在已经跃居世界第三大致盲原因。
根据发表在《柳叶刀全球卫生》上的一篇分析评估:在全球范围内,60岁以上AMD发病率高达11.6%,80岁以上的老人发病率高达27.1%。这也意味着:每9个六十多的老人中,就有1个患有此病,每4个八十多的老人,就有1位老人患有此病。
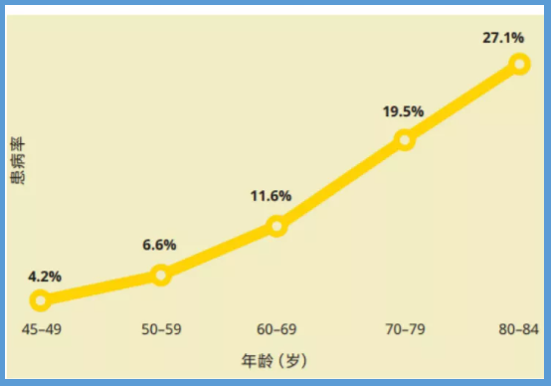
不同年龄人群罹患AMD的比例
刚开始,患有AMD的老年人会出现视力下降,常常以为是老花眼,不大在意。慢慢的,视力会变得越来越差,手机上的字会变得扭曲,根本看不清楚。

AMD患者眼中的世界
再然后,视野里会出现一片挥之不去的“黑云”,视力严重下降···

AMD患者眼中的世界
更令人揪心的是,AMD是一种【眼底病】,一旦出现只会越来越严重,甚至有很高的致盲率。道理很简单,如果把眼睛比作相机,角膜和晶状体就类似于镜头、视网膜就类似于底片。如果【镜头】出问题,一般也就是老花眼,这个容易解决,如果是【底片】出问题,那么戴眼镜根本解决不了问题。

另外,视网膜的损伤是不可逆的,目前的科学技术也不支持视网膜的移植。而AMD这种【眼底病】就是患者的视网膜出了问题。
AMD又分为干性AMD(萎缩型)和湿性AMD(新生血管型),如果是湿性AMD,则视力下降更快,如无治疗介入的话,有80%~90%的湿性AMD会遭受更严重的视力损失。而且干性AMD不加干预,也有转化为湿性AMD的可能。
氢氧混合气体对抗AMD
AMD发病机制:眼睛受到光线的慢性伤害,视网膜和脉络膜间会产生一种硬化沉积物,被称作【隐结】。而【隐结】的形成就标志着干性AMD的产生。
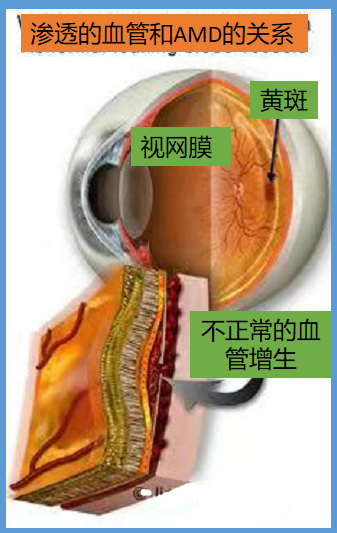
当干性AMD严重时,功能不良的间膜无法组织脉络膜的血管向视网膜增生,由于这种血管组织不良,难以阻挡血管中水液渗出,就会造成水肿,另外也无法组织脂肪蛋白质的渗出物,眼底出现湿润的水气变化,就进展为湿性AMD。
湿性AMD之所以严重,因为当脉络膜破裂出血,患者会发现眼睛有阴影遮挡视线,因为阴影位置在中央部位,所以越想看什么就越看不到,这样的情况不断恶化,直至造成失明。

AMD患者眼中的阴影
科学家发现,这种血管增生和血管内皮生长因子(vascular endothelial growth factor,缩写:VEGF)有密切的关系。VEGF本身是在眼睛中产生的,是正常生理所必须的,但是当损伤、缺氧、缺血发生时,VEGF水平升高,促进内皮细胞增殖和迁移。当然,单靠VEGF的升高,还不能引起湿性AMD的发展,炎症以及随后的萎缩性改变也在起着重要的作用。
由于氢气具有抗炎症、抗氧化、清除恶性自由基等作用。因此,科学家尝试采用氢气治疗湿性AMD【2】
实验设计
因为慢性光伤害可以构成脉络膜新生血管(Choroidal Neovascularization,缩写:CNV),因此科学家使用激光照射小鼠瞳孔,以制造CNV,以此作为AMD模型。同时,科学家将小鼠分为5组。
第一组,对照组:不用激光照射,也不吸氢氧混合气体;
第二组,单纯激光组:只接受激光照射、不吸氢氧混合气体;
第三组,2h组:激光照射+2小时每天氢氧混合吸入;
第四组,5h组:激光照射+5小时每天氢氧混合吸入;
第五组,2.5h+2.5h组:激光照射+两次2.5小时氢氧混合吸入,每次间隔3小时。
其中,小鼠激光照射方法:先使用药物麻醉,再使用药物扩大瞳孔后照射。小鼠吸入氢氧混合气体方法:将小鼠放在密闭亚克力盒子中,再通入高浓度氢氧混合气体;氢氧混合气体产生设备为潓美医疗氢氧气雾化机,产生氢氧混合气体浓度为:66.6%氢气+33.3%氧气,流量为3L/min。

本实验所用潓美氢氧气雾化机
实验中,科学家对小鼠进行彩色眼底照相(CPF)和荧光血管造影(FA),两名视网膜专家使用分级系统以盲法对血管造影照片进行FA分级评估【3】,(其中1级=无超荧光;2级=无泄漏的超荧光;3级=早期或中期超荧光,晚期渗漏;4级=传输中的明亮超荧光和处理区域以外的后期泄漏)
小鼠在第15天被安乐死。每只小鼠的两只眼睛都被摘除,并制作切片。之后将孵育、细胞核染色,再用荧光显微镜进行检查和捕获。
在处死小鼠后,摘除每只小鼠的双眼进行qRT-PCR(实时荧光定量-生物学的聚合酶链反应 ),用于确定编码缺氧诱导因子1α(hypoxia inducible factor-1,HIF-1)、血管内皮生长因子(VEGF)、肿瘤坏死因子α(TNF α)和白细胞介素6(interleukin 6,IL-6)的基因表达的引物列表。
眼底彩照和FA荧光造像
实验开始第五天,小鼠经过激光照射,每个眼睛3点钟、6点钟、9点钟、12点钟方位,形成4个CNV斑块。科学家使用FA荧光血管造影,以展示血管破裂、血液渗透的情况。如下图:
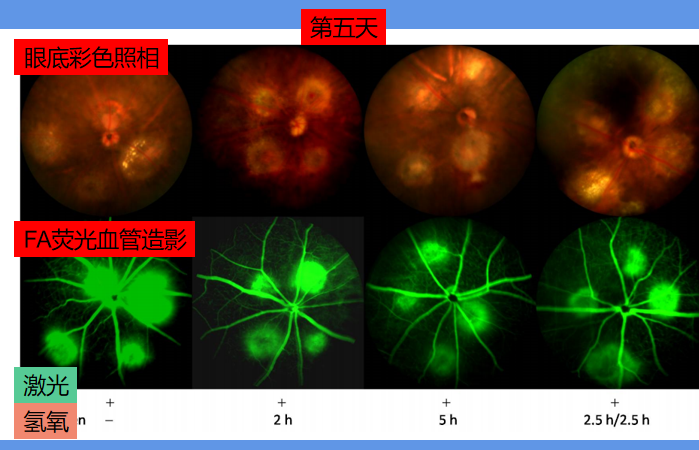
可以看出,单纯用激光,不用氢氧吸入的第一组,FA荧光血管造影面积最大,血管破裂、血液渗透最严重。氢氧吸入的各组,情况要好一些。其中,吸入氢氧混合气体时间更长的5h组和2.5h/2.5h组又比2.5组好一些。
在实验开始第十天后(激光光凝后第五天),科学家再次进行眼底彩色照相和FA荧光血管造影,对比结果更加明显。
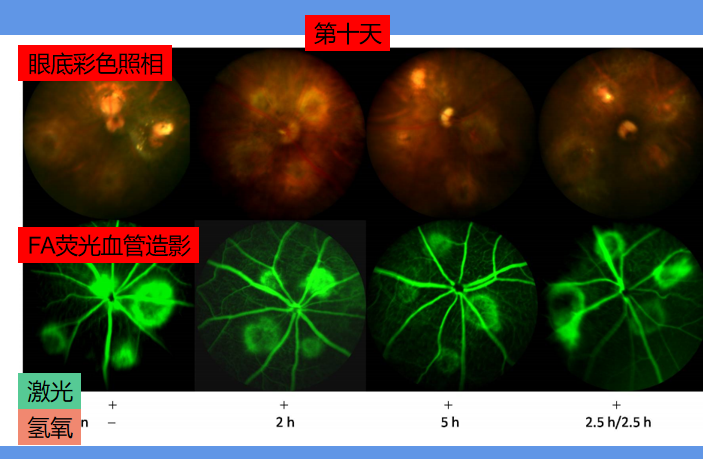
第十天的结果可以看出,吸入氢氧混合气体更多的组,FA荧光造影面积更小。而且眼底照相的光斑也缩小了很多。
视网膜专家对此FA荧光造影的结果进行评分,结果如下:
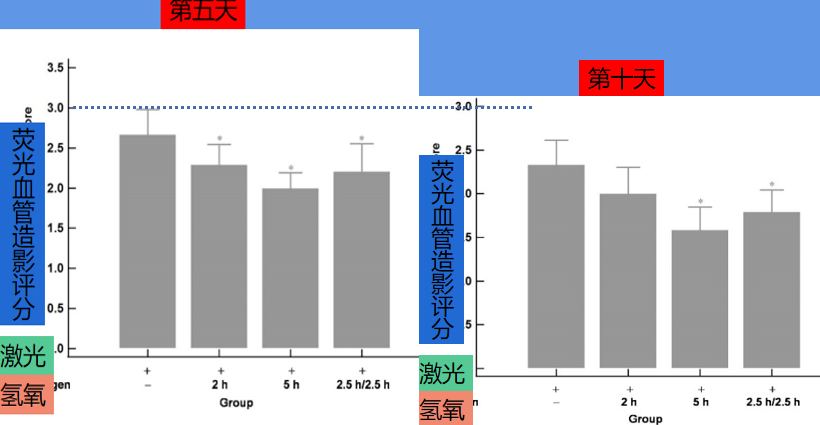
通过评分,可以得出结论。使用氢氧混合气组,CNV恢复效果好于单纯激光照射组。使用5h组和2.5h/2.5h组,要明显好于2h组,而使用5h组又要好于2.5h/2.5h组。
即:5h>2.5h/2.5h>2h>0h
也就是说,氢氧混合气体减轻了CNV、并且抑制了眼底血管破裂、血液渗透的情况。而且氢氧混合气体吸入时间长,效果更好,连续使用比间隔使用效果要好!
组织学变化和免疫染色等
实验第十五天(激光光凝第十天),科学家处死小鼠,并对眼球切片,再使用苏木精-伊红染色,发现了一个现象:仅使用激光的组中几乎没有视网膜色素上皮覆盖在CNV组织上,而在吸入氢氧后,更多的视网膜色素上皮覆盖在CNV组织上。较长的吸入时间导致更多的视网膜色素上皮覆盖。仅使用激光组的CNV组织呈纺锤形,吸入氢气后变得扁平。
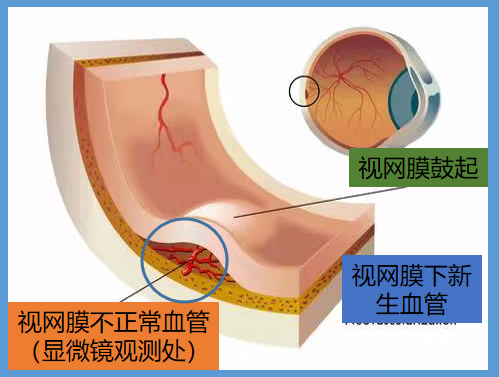
(位置图示)
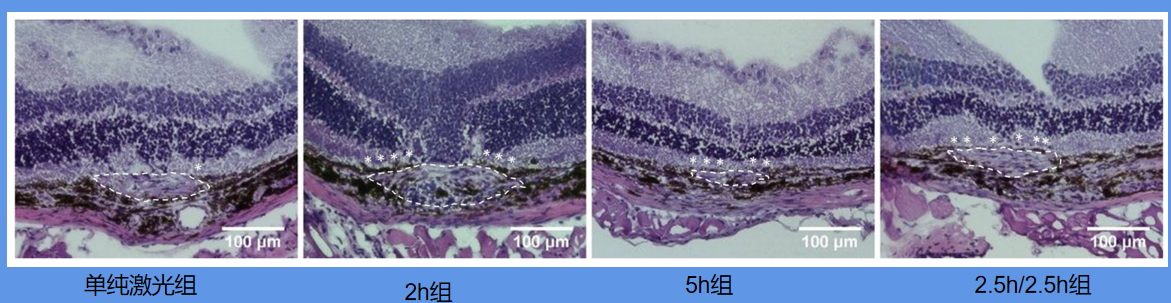
(实际观察,点击放大)
注意看图中白色虚先框出来的地方,这里就是CNV组织。该实验结果非常明显,连续使用5小时CNV组织明显变小很多!同时,CNV组织上的视网膜色素上皮覆盖率(标有星号的深色组织)也有所增加。
免疫荧光染色显示如下图。在氢氧吸入后,血管内皮生长因子受体(磷酸化血管内皮生长因子受体,pVEGFR)磷酸化降低。
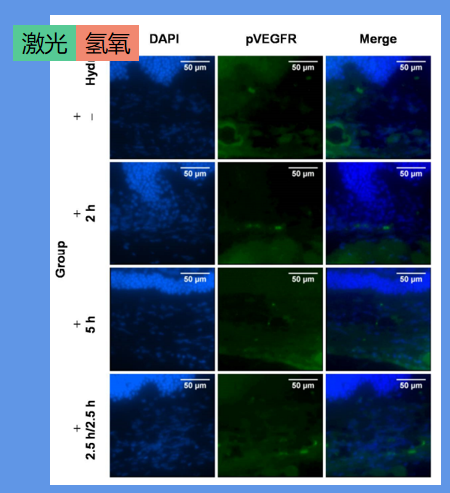
氢氧吸入降低了CNV相关基因的表达
为了解CNV诱导和氢气吸入后的基因表达,科学家们采用了定量逆转录聚合酶链反应。结果显示,激光光凝后缺氧诱导因子-1α(HIF-1)和血管内皮生长因子(VEGF)的表达明显高于对照组(无激光、无氢氧吸入)。如下图:
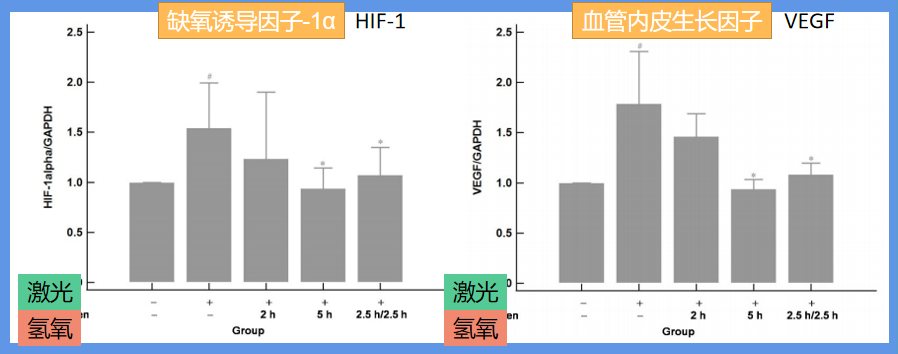
同时,我们也可以看到氢氧吸入有效下调缺氧诱导因子-1α和血管内皮生长因子的基因表达。与2小时组(每天2小时的较短吸入时间)相比,5小时组(每天5小时的较长吸入时间)的效果更显著。5小时组和2.5小时/2.5小时组的效果相似,这表明,在这两种基因的表达这个层面,间断吸入可以达到与连续吸入相似的效果。
促炎介质肿瘤坏死因子-α(TNF-α)和白细胞介素-6(IL-6)的基因表达通过定量逆转录聚合酶链反应检测。结果如下图:
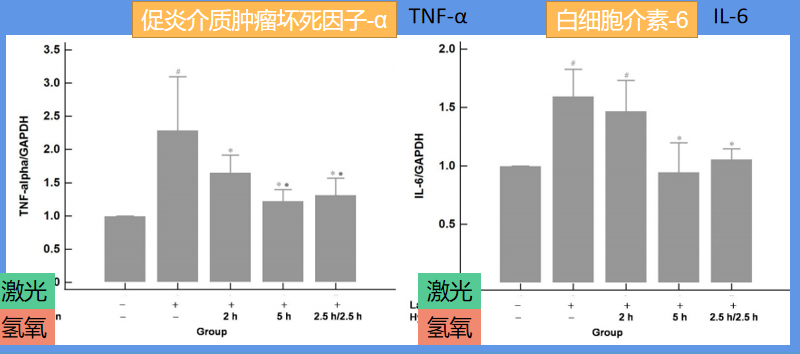
与对照组(无激光或氢气吸入)相比,激光凝固后肿瘤坏死因子-α(TNF-α)和白细胞介素-6(IL-6)的表达显著升高。这种升高可以通过吸入氢气有效地降低。5小时和2.5小时/2.5小时组的效果大致相同,优于2小时组。
氢氧吸入对抗AMD前景
研究发现,炎症过程和随后的萎缩性改变在AMD中起着重要作用。单靠血管内皮生长因子的增加可能还不足以引起AMD的发展,这意味着VEGF驱动的途径仅仅是复杂的机械调节的一部分。
但是,目前新生血管性AMD的金标准疗法在给玻璃体内给予血管内皮生长因子抑制剂(VEGFR Inhibitor)。临床使用的药物包括贝伐单抗、ranibizumab、aflibercept和brolucizumab,但这些药物作用不明显,而且副作用比较大,所以患者往往配合度不高。
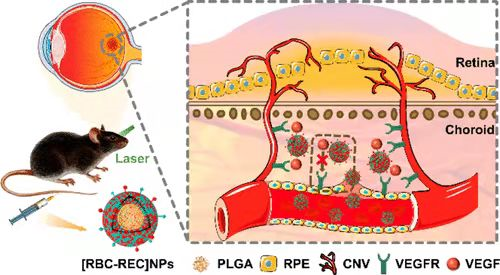
为了控制VEGF作用于血管,使用VEGFR Inhibitor的靶向药物。
但在氢氧吸入的实验中,科学家发现,高浓度氢氧混合吸入可以:
(1)减少CNV泄漏;
(2)通过下调血管内皮生长因子和缺氧诱导因子-1α抑制CNV形成的血管内皮生长因子依赖性途径;
(3)通过抑制肿瘤坏死因子-α和白细胞介素-6的表达来抑制血管内皮生长因子非依赖性途径。
所以,可以判断,高浓度氢氧混合吸入在对抗新生血管性AMD方面,更具全面性,前景巨大。
补充和讨论
研究表明,氢氧吸入可以抑制布鲁赫膜(脉络膜毛细血管层和视网膜视部色素上皮间薄薄的膜状结构)破裂后受损视网膜的炎症,抑制CNV发展,减少CNV渗漏。同时,实验也证明了吸入氢氧气可以显著减少CNV泄漏,效果呈现吸入时间依赖性。
对AMD患者手术切除的CNV的组织学检查显示,CNV由血管成分(内皮细胞、周细胞和内皮细胞的前体)和血管外成分(神经胶质细胞、视网膜色素上皮细胞、成纤维细胞和炎症细胞,包括巨噬细胞、淋巴细胞、粒细胞和异物巨细胞)组成【4】。
因此,炎症和血管生成都参与了CNV病的发展!
血管内皮生长因子(VEGF)已被确定为病理性新血管形成的关键介质之一(但不唯一),其在眼部血管生成中发挥作用【5】。
血管内皮生长因子在CNV的最初发育中是必不可少的,因为它是内皮细胞增殖和迁移的刺激因子。视网膜色素上皮细胞、神经节细胞、视网膜神经元、米勒细胞和免疫细胞,如巨噬细胞和单核细胞,会响应缺氧和炎症刺激分泌血管内皮生长因子【6】。
缺氧反应由缺氧诱导因子介导,缺氧诱导因子是一个转录调节因子家族,负责调节参与缺氧反应的基因,包括血管内皮生长因子。缺氧诱导因子-1α是,已被发现存在于活跃的CNV标本中。【7】
在分支视网膜静脉阻塞大鼠模型中,氢氧吸入已被证明通过降低VEGF表达来减轻视网膜水肿和促进视网膜功能恢复【8】。该实验结果表明,氢氧吸入不仅可以抑制血管内皮生长因子,还可以抑制上游翻译因子缺氧诱导因子。
抗血管内皮生长因子药物治疗可以成功抑制CNV活性,并解决与CNV相关的血管渗漏和黄斑出血,但不足以根除CNV并治愈该疾病。CNV只持续了部分衰退或在多年后复发【9】此外,发现一部分患者对抗血管内皮生长因子治疗无反应【10】。因此,血管内皮生长因子驱动的通路只是调节眼睛血管生成的复杂机制的一部分。调节血管内皮生长因子以外的眼部血管生成是目前治疗新生血管性AMD的目标。
众所周知,巨噬细胞和许多细胞因子是通过多种机制调节眼部血管生成的重要角色。巨噬细胞对于正常的视网膜血管重塑至关重要,在调节视网膜新生血管形成中也起着关键作用【11】。
巨噬细胞活性的减少可以减少CNV的大小和渗漏【12】。白细胞在缺氧条件下被募集,破裂的布鲁赫膜中不断增加的巨噬细胞引起肿瘤坏死因子-α的产生和白细胞介素的合成,并刺激视网膜色素上皮细胞产生趋化因子【13】。
肿瘤坏死因子-α是巨噬细胞源性血管生成的主要细胞因子。在肿瘤坏死因子-α高水平的患者中,新血管性AMD的患病率增加了近5倍【14】。科学家还发现,【肿瘤坏死因子受体抑制剂】能够抑制炎症和糖尿病视网膜病变大鼠模型中的【血-视网膜屏障破坏】【15】。
新生血管性AMD患者血液中高水平的白介素-6与疾病进展呈正相关。在新生血管性AMD的CNV病变中,由活化巨噬细胞表达的IL-6增加,并且【抑制IL-6信号传导】可以抑制视网膜下纤维化,这是中端AMD的重要表现。靶向白介素-6和相应的信号通路将不仅接近治疗CNV,而且接近预防视网膜下纤维化和最终的黄斑瘢痕形成。
氢氧吸入已被证明可降低缺血/再灌注损伤或视网膜、肝脏和大脑中炎性细胞因子的水平,包括TNF-α、IL-1β和IL-6。在目前的实验中,氢氧混合吸入可以有效抑制肿瘤坏死因子-α和白细胞介素-6的基因表达。还发现了吸入时间依赖性效应。
文章致谢:作者感谢中国上海潓美医疗科技有限公司和中国台湾辅仁天主教大学医学院宗倬章实验室的技术援助。
注意:以上实验仅处于初步阶段,不可替代药物及专业医师指导,不具备临床指导意义。